 SMAはⅠ型からⅣ型までありますが、新生児マススクリーニングの主なターゲットはⅠ型となります。
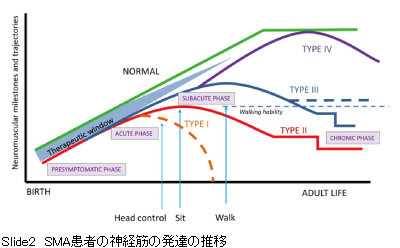
SMAはⅠ型からⅣ型までありますが、新生児マススクリーニングの主なターゲットはⅠ型となります。神経筋の発達の状態を健常者とSMAとで比較してみます。 Ⅰ型は生後無症候のpresymptomatic phaseを経て、急性期acute phaseに移行し発症していきます。だいたいその間隔は1ヵ月程度と考えられています。
この間に、新生児マススクリーニングを行い、遺伝子治療を開始すれば、大人まで普通の成長発達が出来ると期待されています。
ですから生後1ヵ月を目途に診断治療を開始できるかが鍵となっています。SMAの治療法が確立された今の段階での喫緊の課題となっています。
後述しますが、Ⅰ型では責任遺伝子SMN1の約95%で遺伝子の欠失がみられています。ですから、できるだけ早い時点で診断していくような、検査戦略を立てることが重要です。
遠藤 ゾルゲンスマは投与対象に年齢制限はありますか
羽田 2歳未満です。未発症でもⅠ型、Ⅱ型、Ⅲ型、Ⅳ型など型に関係なく、適応となります。遺伝的に見つかった場合、すべて治療対象となります。
羽田 2歳未満です。未発症でもⅠ型、Ⅱ型、Ⅲ型、Ⅳ型など型に関係なく、適応となります。遺伝的に見つかった場合、すべて治療対象となります。
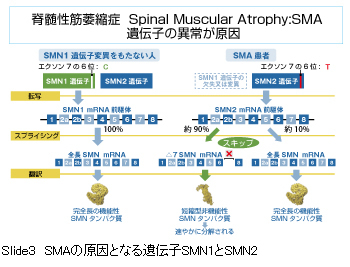 SMAの原因となる遺伝子はSMN(survival motor neuron)遺伝子といいます。特殊な構造をしており、SMN1とSMN2は同じ方向で同一染色体上に位置しています。責任遺伝子はSMN1です。
SMN1遺伝子変異をもたない人は、SMN1遺伝子が正常に機能し、完全長の機能性SMNタンパク質が合成できます。
SMAの原因となる遺伝子はSMN(survival motor neuron)遺伝子といいます。特殊な構造をしており、SMN1とSMN2は同じ方向で同一染色体上に位置しています。責任遺伝子はSMN1です。
SMN1遺伝子変異をもたない人は、SMN1遺伝子が正常に機能し、完全長の機能性SMNタンパク質が合成できます。一方、SMAではSMN1の欠失がみられ、正常な完全長の機能性SMNタンパク質が合成できません。Ⅰ型患者の約95%で責任遺伝子SMN1遺伝子の欠失がみられています。
SMN2はSMN1と塩基の構造が少し異なり、エクソン7をスキップしてしまうため、ほとんどが短縮型非機能性SMNタンパク質となり、正常な完全長の機能性SMNタンパク質は約10%程度しか合成できません。
従来のSMA治療薬ヌシネルセンはこのSMN2に作用して、正常な完全長SMNタンパク質の発現を増加させる作用機序を持つ核酸医薬品(ASO)です。 一方、新しいSMA治療薬のゾルゲンスマは、欠失したSMN1を遺伝子治療により発現させる作用機序の薬剤です。
SMAは遺伝病であり、常染色体劣性の遺伝形式です。遺伝子は2つのアレルがあり、そのうち1本に欠失がある場合は保因者となります。もし、患者さんが発見された場合、両親とも保因者ということになるかと思います。 その場合、発症は1/4の確率になりますが、実際には第一子、第二子と続けて発症する場合もあります。
ですから、1人目が診断されている場合、2人目はすぐ治療を開始することが重要です。 大部分はそういった局面はないことが多いですから、新生児スクリーニングで診断して、早期に発見し、早期治療を開始し、発症を防ぐことが大変重要になるわけです。
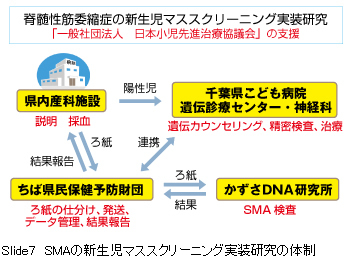 SMAの新生児マススクリーニング実装研究について、最後にお話しします。
SMAの新生児マススクリーニング実装研究について、最後にお話しします。私たちは、新生児マススクリーニングにSMAを入れることを、実装研究と名付けています。 その流れは図のようになります。
まず、県内産科施設において、妊婦で希望者にインフォームド・コンセントを実施し、参加したいという方には全例検査を行います。一応、千葉県内すべの産科施設にお声がけをして説明しています。
その際、今のスクリーニングで使っているろ紙血を使うことが重要で、その許可を千葉県・千葉市をいただくことを最初に行いました。 公益財団法人 ちば県民保健予防財団では、既存のスクリーニングで、ろ紙の発送、血液ろ紙の受け取り、データ管理、結果管理まで検査部で行っています。
その為、千葉県全体の産科施設から毎日、血液ろ紙が送られてきています。
2019年12月に遠藤先生からお話しがあってから、急ピッチで体制を立ち上げています。現在、県内産科施設でご説明した妊婦の70%から同意が得られているところです。
検査ですが一からやるのはハードルが高いため、難病の解析や遺伝子研究や開発を行っている公益財団法人 かずさDNA研究所でSMA検査をお願いしているところです。 ろ紙を一部パンチアウトして、96穴マイクロプレートに入れて毎日かずさDNA研究所に送付しています。
その結果は数日で解析され結果が返却され、産科施設に1ヵ月以内に結果を報告するという流れです。
陽性が出た場合、産科に連絡し、陽性児の両親に連絡し、直ちに千葉県こども病院の村山 圭先生を受診してもらいます。 千葉県こども病院では、遺伝診療センターでの遺伝カウンセリングおよびSMAの確定診断、確定後の神経科による早期治療の一連のシステムは確立しています。
現在、従来の方法で発見された1歳半と三か月齢のSMAの患者さんに対しゾルゲンスマの治療を開始するところで、これにより新生児マススクリーニングによる早期診断、複数の早期治療体制がスタートすることになります。
遠藤 同意書が70%程度ということですが、進捗状況としては相当進んでいるように思いますが。
羽田 そうですね。参加していない産科施設もありますし、コロナの影響もあります。これから徐々に進んで行くと思います。
遠藤 千葉県では、新生児はどの程度カバーできるのですか。
羽田 千葉全体でお産の数は年間で4万数千人ですから、約3万人程度の新生児の検査が可能だと思います。近々患者さんが見つかる可能性も高いと考えています。
羽田 そうですね。参加していない産科施設もありますし、コロナの影響もあります。これから徐々に進んで行くと思います。
遠藤 千葉県では、新生児はどの程度カバーできるのですか。
羽田 千葉全体でお産の数は年間で4万数千人ですから、約3万人程度の新生児の検査が可能だと思います。近々患者さんが見つかる可能性も高いと考えています。