2023年10月1日
脊髄性筋萎縮症の
新生児スクリーニング費用対効果分析について
お話し
公益財団法人ちば県民保健予防財団調査研究センター長
羽田 明 先生
聞き手
一般社団法人 日本スクリーニング研究所 代表理事
くまもと江津湖療育医療センター総院長
遠藤 文夫 先生
遠藤 脊髄性筋萎縮症(Spinal Muscular Atrophy: SMA)の新生児スクリーニング(Newborn Screening: NBS)が普及しつつあります。一部の地域では公費助成が実施されています。NBSの実施においては費用対効果が重要な要素になるという考え方があります。そこでSMAのNBSについて、基本的なことを教えてください。
質問項目
質問項目
- 費用対効果において、効果指標は質調整生存年(Quality Adjusted Life Year: QALY)を用いることを原則とするといわれています。どのようなデータをもとに算出されますか ? また、その数値はどんな意味がありますか ?
- 費用対効果分析が実施できる条件について教えてください。
- SMAの新生児スクリーニングについて、現時点で判定できる範囲で、費用対効果はどのように算出されているでしょうか ?
- 欧米では新生児ゲノム配列解析が始まっています。費用対効果についての議論はなされておりますでしょうか ?
- 最後に千葉県でのSMAスクリーニングの状況について教えてください。
1. 費用対効果において、効果指標は質調整生存年(Quality Adjusted Life Year: QALY)を用いることを原則とするといわれています。どのようなデータをもとに算出されますか ? また、その数値はどんな意味がありますか ?
羽田 まずQOL値は0から1までの値をとります。QOL値が1の場合が完全な健康、0の場合が死亡を表します。障害を持つとその症状によって0から1の間をとりますが、例えば今回の解析では、SMA患者の運動機能に関して、支えなしに座れる状態のQOL値を、臨床現場を担当する医師の意見を集約したデータから0.6としました。
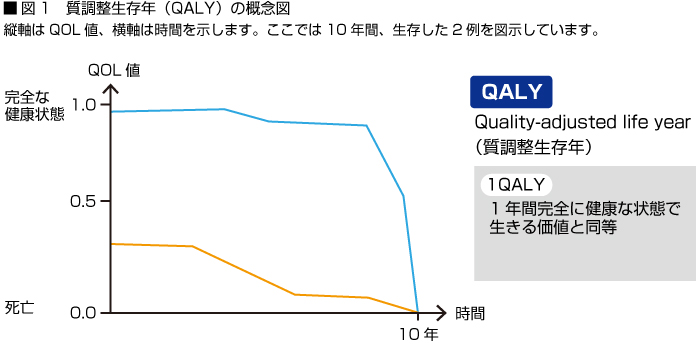
QALYはこのQOL値と生存年を乗じたものとなります。従ってQOL値0.6を保ったまま3年間生存した場合、QALYは0.6×3=1.8となり、完全な健康の人が1.8年間生きたのと同じ値となります。現実には、疾患の場合、時間と共に(年齢とともに)QOL値が減少する事が多いため、この場合は図1の様にQOL値の経時的変化を表す曲線下面積で表します。
この図で青い線の経過とオレンジの線の経過を見ると、両者とも10年間、生存していますが、青い線の場合、9年目まではQOL値は0.8以上を保っていますので、QALYは7以上となります。一方、オレンジの経過では最初の時点でQOLが0.3でその後比較的、早い速度で低下していますのでQALYは2程度となります。この様にQALYを計算する事により、効果にQOLのレベルを考慮する事ができるのです。
QALYはこのQOL値と生存年を乗じたものとなります。従ってQOL値0.6を保ったまま3年間生存した場合、QALYは0.6×3=1.8となり、完全な健康の人が1.8年間生きたのと同じ値となります。現実には、疾患の場合、時間と共に(年齢とともに)QOL値が減少する事が多いため、この場合は図1の様にQOL値の経時的変化を表す曲線下面積で表します。
この図で青い線の経過とオレンジの線の経過を見ると、両者とも10年間、生存していますが、青い線の場合、9年目まではQOL値は0.8以上を保っていますので、QALYは7以上となります。一方、オレンジの経過では最初の時点でQOLが0.3でその後比較的、早い速度で低下していますのでQALYは2程度となります。この様にQALYを計算する事により、効果にQOLのレベルを考慮する事ができるのです。
2. 費用対効果分析が実施できる条件について教えてください。
羽田 一般に以下のような条件が記載されています。
| A) | 疾患の自然史がわかっている。 |
| B) | 疾患の状態の移行確率がわかっている。 |
| C) | 各状態のQOL値がわかっている(QALY以外を効果の指標とすると、費用対効果が良いと判断する基準がない)。 |
| D) | 各状態に必要な費用が計算できる。 |
| (ア) | 標準的な治療法があれば、積み上げ方式 | |
| (イ) | 治療法が定まっていない場合は、レセプト等からその状態のときに現実世界で消費されている費用を見積もる |
A) は例えばSMAⅠ型の場合、2年程度で自力呼吸ができなくなり、人工呼吸器の装着が必要となるという自然史がわかっています。
B) は例えば抗がん剤の場合、既存治療および新規治療ではどの程度、再発するか、死亡するかなどの確率がこれにあたります。
C) は支援なしで歩ける状態、一人座りできる状態、一人座りができない状態、持続的に人工呼吸器を使う必要がある状態などを、過去の文献、過去の研究、専門家の意見などを集約して設定します。
D) は主に公表されているデータや報告から計算します。
B) は例えば抗がん剤の場合、既存治療および新規治療ではどの程度、再発するか、死亡するかなどの確率がこれにあたります。
C) は支援なしで歩ける状態、一人座りできる状態、一人座りができない状態、持続的に人工呼吸器を使う必要がある状態などを、過去の文献、過去の研究、専門家の意見などを集約して設定します。
D) は主に公表されているデータや報告から計算します。
3. SMAの新生児スクリーニングについて、現時点で判定できる範囲で、費用対効果はどのように算出されているでしょうか ?
羽田 一般に費用対効果分析の解釈は、1QALYを上げるために500万円以下で達成できる場合を「費用対効果が良い」と判断しますが、SMAの様な小児難病や悪性腫瘍などの疾患を対象とした場合、これより高額である750万円以下という基準が適応されます。
今回、SMA患者に対するNBSの費用対効果をNBS未実施と比較して評価しました。実際は現在の治療法が適応され始めてからまだ年数が不足しているため、QOLが生涯、高いレベルで維持できるかはわかりません。今回、解析に使ったモデルでは、臨床試験の追跡調査終了時に達成された運動マイルストーンが死亡するまで持続すると仮定しています。発症してからの各治療を受けている患者の割合は、日本の臨床での実態に基づいていますので、今後もこの割合が続くとしています。
その他、スクリーニングに要する費用、発症した患者に要する直接医療費などは日本の診療情報請求データベースから得ています。
その結果、公的医療の立場での基本分析(公的医療費がどの程度、必要となるかを解析)ではNBS群の方が費用の面でも90億円程度、安価である可能性が示唆され、QALYからみた効果の面でも優位という結果を得ています。また、社会的な立場でのシナリオ分析(基本分析に加えて、療育などに必要な様々な費用を投入)でも、数値は変わりますが同様の結果を得ています。
今回、SMA患者に対するNBSの費用対効果をNBS未実施と比較して評価しました。実際は現在の治療法が適応され始めてからまだ年数が不足しているため、QOLが生涯、高いレベルで維持できるかはわかりません。今回、解析に使ったモデルでは、臨床試験の追跡調査終了時に達成された運動マイルストーンが死亡するまで持続すると仮定しています。発症してからの各治療を受けている患者の割合は、日本の臨床での実態に基づいていますので、今後もこの割合が続くとしています。
その他、スクリーニングに要する費用、発症した患者に要する直接医療費などは日本の診療情報請求データベースから得ています。
その結果、公的医療の立場での基本分析(公的医療費がどの程度、必要となるかを解析)ではNBS群の方が費用の面でも90億円程度、安価である可能性が示唆され、QALYからみた効果の面でも優位という結果を得ています。また、社会的な立場でのシナリオ分析(基本分析に加えて、療育などに必要な様々な費用を投入)でも、数値は変わりますが同様の結果を得ています。
4. 欧米では新生児ゲノム配列解析が始まっています。費用対効果についての議論はなされておりますでしょうか ?
羽田 私の調べた範囲では、NBSにWGS(whole-genome sequencing)、WES(whole-exome sequencing)解析を入れる事のメリット・デメリットの検討(Woerner AC et al. Frontiers in Pediatrics. 9, 1-13, 2021)で既存のスクリーニング対象疾患では感度が低いので入れ替えることはできないだろう、それなりのメリットはある、コストに関して年長で発症する疾患のフォローアップなどのコストも考えるべきなどの記載はありましたが、費用対効果についての記載はありません。
他にWGSを診断方法に入れた場合のコスト増分の検討(Christensen KD et al. Genetics in Medicine. 20, 1544-1553, 2018)、遺伝性疾患が疑われる症例でWGSを診断として採用した場合のコスト増加の評価(Dragojlovic N et al. Genetics in Medicine, 22, 292-300, 2020)、遺伝性疾患が疑われる新生児・小児の診断する場合、WGSとWESのどちらの費用対効果が高いかの評価(Nurchis MC et al. Health Policy, 126, 337-345, 2022)などがあります。
しかし現時点では有用性の評価の段階で、NBSにWGSを採用する事の費用対効果の検討には至っていないのではないかと思います。
他にWGSを診断方法に入れた場合のコスト増分の検討(Christensen KD et al. Genetics in Medicine. 20, 1544-1553, 2018)、遺伝性疾患が疑われる症例でWGSを診断として採用した場合のコスト増加の評価(Dragojlovic N et al. Genetics in Medicine, 22, 292-300, 2020)、遺伝性疾患が疑われる新生児・小児の診断する場合、WGSとWESのどちらの費用対効果が高いかの評価(Nurchis MC et al. Health Policy, 126, 337-345, 2022)などがあります。
しかし現時点では有用性の評価の段階で、NBSにWGSを採用する事の費用対効果の検討には至っていないのではないかと思います。
5. 最後に千葉県でのSMAスクリーニングの状況について教えてください。
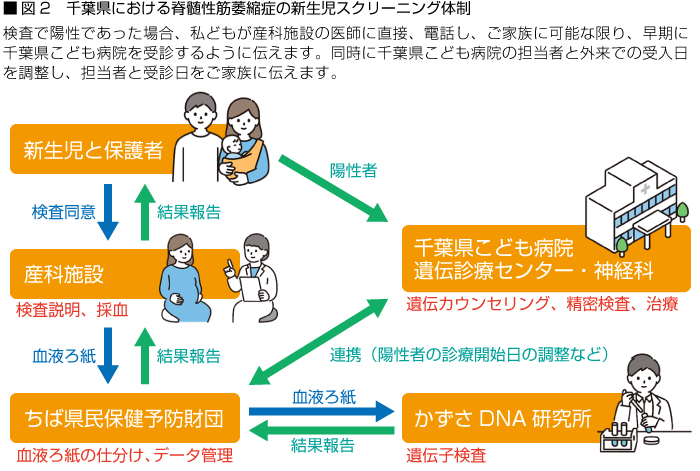
羽田 2020年度から全国に先駆けて、千葉県全体を対象としたSMA検査追加の実装研究を行い、すべてのステップで特に問題なく運用できましたので、その成果を基に2021年度から、有料事業として運用しています。千葉県におけるSMA検査、結果報告、陽性が出た場合の流れを図2にまとめました。2024年度からは検査も財団内で実施する予定で、現在、準備をしています。
2020年の実装研究開始以来、陽性例は出ませんでしたが、2022年11月、同年12月に立て続けに2例、2023年度になって1例の患者がみつかり、いずれも生後1か月前後での遺伝子治療につながりました。実装研究時は研究費で検査を実施していた為、自己負担はありませんでしたが、2021年度からの有料事業ではスクリーニング実施施設は99施設中、61施設(61.6%)、スクリーニング件数は36,684件中、15.090件(41.1%)と受検率は半数程度にとどまっています。
実際、新生児期のスクリーニング未参加の方の中から、発症後に検査を依頼され、診断に至った症例がでてしまいました。公費助成への働きかけと共に、より一層、千葉県民を対象として啓発していくことが必要だと感じています。
2020年の実装研究開始以来、陽性例は出ませんでしたが、2022年11月、同年12月に立て続けに2例、2023年度になって1例の患者がみつかり、いずれも生後1か月前後での遺伝子治療につながりました。実装研究時は研究費で検査を実施していた為、自己負担はありませんでしたが、2021年度からの有料事業ではスクリーニング実施施設は99施設中、61施設(61.6%)、スクリーニング件数は36,684件中、15.090件(41.1%)と受検率は半数程度にとどまっています。
実際、新生児期のスクリーニング未参加の方の中から、発症後に検査を依頼され、診断に至った症例がでてしまいました。公費助成への働きかけと共に、より一層、千葉県民を対象として啓発していくことが必要だと感じています。